La identidad de un átomo está determinada por su número atómico (Z), el cuál es el número de protones en el núcleo del átomo. El número de masa (A) es el número total de neutrones y protones en el núcleo. Si el símbolo del elemento es X, entonces la posición de Z o de A, sería la siguiente:

No todos los átomos de un elemento tienen la misma masa. Estos se llaman Isótopos: átomos de un mismo elemento pero con diferente número de masa. El hidrógeno, por ejemplo, tiene 3 Isótopos llamados Hidrógeno, Deuterio y Trítio.

La Tabla periódica, según la IUPAC (Unión Internacional de Química Pura y Aplicada). Se hace referencia a los elementos en forma colectiva, mediante su número de grupo en la tabla periódica. Algunos grupos tienen nombres especiales. 1A (Metales alcalinos), 2A (Metales alcalinoides), 7A (Halógenos), 8A (Gases nobles).

Molécula: es un agregado de dos o más átomos unidos a través de fuerzas llamadas enlaces químicos. Pueden ser átomos de un mismo elemento, o de diferentes elementos.
Compuesto: está formado por átomos de dos o más elementos.
Ión: es un átomo o grupo de átomos con carga neta positiva o negativa. El número de protones cargados positivamente en el núcleo del átomo permanece constante durante la reacción química. Pero se pueden perder o ganar electrones, cargados negativamente. La pérdida de uno o más electrones a partir de un átomo neutro forma un catión: Ión cargado negativamente. La ganancia de uno o más electrones, en cambio, forma un anión: Ión cargado positivamente.
De este último hecho se genera el Número de Oxidación: número entero que representa el número de electrones que un átomo pone en juego. El número de oxidación es positivo si el átomo tiene tendencia a ceder electrones (Metales). El número de oxidación es negativo si el átomo tiene tendencia a aceptar electrones (No Metales).
Cationes. Se formulan poniendo el símbolo del elemento con un exponente igual a su número de oxidación (carga positiva). Se nombran mediante la nomenclatura de composición. La mayoría de ellos se originan de un metal:

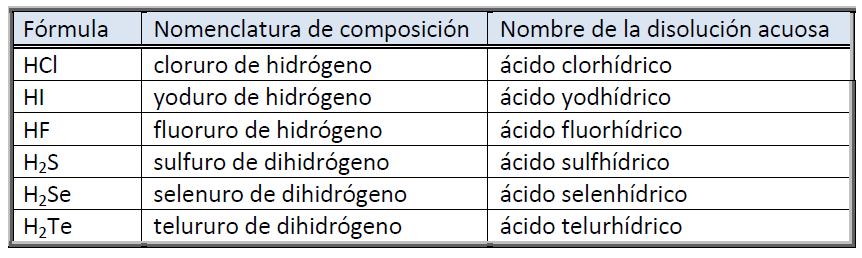
Aniones. Se formulan poniendo el símbolo del elemento con un exponente igual a su número de oxidación (carga negativa). Se nombran mediante la nomenclatura de composición terminado en -uro. La mayoría de ellos se originan de un no-metal:

Muchos compuestos iónicos son binarios, es decir, compuestos por dos elementos. Por ejemplo, el cloruro de sodio (NaCl) está formado por cationes y aniones de dos elementos.
Fórmula molecular: indica el número exacto de átomos de cada elemento presentes en su unidad. Mientras, la Fórmula Empírica indica los elementos presentes en su proporción mínima.

En los compuestos iónicos el arreglo de cationes y aniones, debe ser de tal forma que los compuestos sean eléctricamente neutros. La suma de las cargas de cationes y aniones debe ser igual a cero. Se aplica la siguiente regla cuando se unen un catión y un anión: el subíndice del catión debe ser numéricamente igual a la carga del anión; el subíndice del anión debe ser numéricamente igual a la carga del catión.
Los compuestos inorgánicos se dividen en cuatro categorías: compuestos iónicos, compuestos moleculares, ácidos, bases e hidratos. A su vez, estos compuestos pueden ser binarios, ternarios, cuaternarios, etc.
En la siguiente guía, encontramos el concepto para cada una de estas categorías:
Nomenclatura Q Inorgánica 1920
Fuente:
Quimica_11va_Edicion_Raymond_Chang_FREEL
SIGUIENTES:
Revisión literaria hecha por:
Prof. Larry Francis Obando – Technical Specialist – Educational Content Writer
WhatsApp: +34633129287 Atención Inmediata!!
Copywriting, Content Marketing, Tesis, Monografías, Paper Académicos, White Papers (Español – Inglés)
Escuela de Ingeniería Eléctrica de la Universidad Central de Venezuela, UCV CCs
Escuela de Ingeniería Electrónica de la Universidad Simón Bolívar, USB Valle de Sartenejas.
Escuela de Turismo de la Universidad Simón Bolívar, Núcleo Litoral.
Contacto: España. +34633129287
Caracas, Quito, Guayaquil, Cuenca.
WhatsApp: +34633129287 +593998524011
FACEBOOK: DademuchConnection
email: dademuchconnection@gmail.com